Generalidades:
Se entiende por disolución toda mezcla homogénea de dos o más componentes en proporción variable.
Las disoluciones objeto de nuestro estudio serán binarias, en las que un cuerpo (soluto) se dispersa de una manera homogénea en el seno de otro componente (disolvente).
- El disolvente (solv), es el componente mayoritario de la disolución, puede ser un sólido, un líquido o un gas.
- El Soluto (sto): es el componente minoritario de la disolucion o solucion, es decir el que se encuentra en menor cantidad (masa, moles etc).
De acuerdo a lo anterior se tiene que generalmente (no siempre) en una disolucion o solucion
El soluto < El disolvente
 |
| Figura 1 "Disolución" |
La suma del soluto y el disolvente o solvente es igual a la disolucion:
Disolución = soluto + disolvente
- Disolución de glucosa (líquido) en H2O (liquido): glucosa(acuosa); C6H12O6 (acuosa)
- Disolución de metanol(líquido) en H2O(líquido); metanol(acuosa); CH3OH(acuosa)
- Disolución de O2 (g) en H2O(líquido)
- Disolución acuosa de NaCl, KCl, CaCl2 y C6H12O6 [un suero fisiológico]
Concentracion de una disolución
La concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución, y a mayor proporción más concentrada ésta
A menudo en el lenguaje informal, no técnico, la concentración se describe de una manera cualitativa, con el uso de adjetivos como "diluido" o "débil" para las disoluciones de concentración relativamente baja, y de otros como "concentrado" o "fuerte" para las disoluciones de concentración relativamente alta. En una mezcla, esos términos relacionan la cantidad de una sustancia con la intensidad observable de los efectos o propiedades, como el color, sabor, olor, viscosidad, conductividad eléctrica, etc, causados por esa sustancia. Por ejemplo, la concentración de un café puede determinarse por la intensidad de su color y sabor, la de una limonada por su sabor y olor, la del agua azucarada por su sabor.
Dependiendo de la proporción de soluto con respecto al disolvente, una disolución puede estar diluida o concentrada:
- Disolución diluida: Es aquella en donde la cantidad de soluto está en una pequeña proporción en un volumen determinado.
- Disolución concentrada: Es la que tiene una cantidad considerable de soluto en un volumen determinado. Las soluciones saturadas y sobresaturadas son altamente concentradas.
Formas de expresar la concentración
La concentración de una disolución viene dada por la proporción entre sus componentes (soluto y disolvente) o entre el soluto y la disolución.
Esta relación se puede establecer desde el punto de vista cualitativo o cuantitativo y, dentro de esto último tomar como base de referencia la masa o el volumen.
Las diversas formas de expresión las esquematizamos en el siguiente cuadro:
 | ||||
| Tabla 1- "Forma de expresar la concentración de las disoluciones". |
De forma cualitativa
- Disolución insaturada: Cuando la cantidad de soluto disuelta es pequeña en relación con la cantidad de disolvente.
- Disolución concentrada: Disolución que contiene gran cantidad de soluto respecto a la de disolvente, sin llegar al límite de saturación.
- Disolución saturada: Cuando el disolvente no admite ya más cantidad de soluto,a esa temperatura.
- Disolución sobresaturada: Es aquella que contiene más sustancia disuelta que la que le correspondería en relación a la temperatura. Por evaporación o adición de cristales de soluto, puede producirse una cristalización, debido al exceso de soluto.
Para usos científicos o técnicos, una apreciación cualitativa de la concentración casi nunca es suficiente, por lo tanto las medidas cuantitativas son necesarias para describir la concentración.
A diferencia de las concentraciones expresadas de una manera cualitativa o empírica, las concentraciones expresadas en términos cuantitativos o valorativos toman en cuenta de una manera muy precisa las proporciones entre las cantidades de soluto y disolvente que se están utilizando en una disolución. Este tipo de clasificación de las concentraciones es muy utilizada en la industria, los procedimientos químicos, en la farmacia, la ciencia, etc, ya que en todos ellos es necesario mediciones muy precisas de las concentraciones de los productos.
Hay varias maneras de expresar la concentración cuantitativamente, basándose en la masa, el volumen, o ambos. Según cómo se exprese, puede no ser trivial convertir de una medida a la otra, pudiendo ser necesario conocer la densidad. Ocasionalmente esta información puede no estar disponible, particularmente si la temperatura varía. Por tanto, la concentración de la disolución puede expresarse como:
- Porcentaje masa-masa (% m/m)
- Porcentaje volumen-volumen (% V/V)
- Porcentaje masa-volumen (% m/V)
- Molaridad
- Molalidad
- Normalidad
- Fracción molar
- Partes por millón (ppm)
- Partes por billón (ppb)
- Partes por trillón (ppt)
Porcentaje masa-masa (% m/m)
Se define como la masa de soluto (sustancia que se disuelve) por cada 100 gramos de disolución:

Porcentaje volumen-volumen (% V/V)
Expresa el volumen de soluto por cada cien 100 mililitros de disolución. Se suele usar para mezclas líquidas o gaseosas, en las que el volumen es un parámetro importante a tener en cuenta. Es decir, el porcentaje que representa el soluto en el volumen total de la disolución. Suele expresarse simplificadamente como % v/v.

Por ejemplo, si se tiene una disolución del 20% en volumen (20% v/v) de alcohol en agua quiere decir que hay 20 mL de alcohol por cada 100 mL de disolución.
Porcentaje en masa- volumen (% m/V)
Se pueden usar también las mismas unidades que para medir la densidad aunque no conviene combinar ambos conceptos. La densidad de la mezcla es la masa de la disolución dividida por el volumen de ésta, mientras que la concentración en dichas unidades es la masa de soluto dividida por el volumen de la disolución por 100. Se suelen usar gramos por mililitro (g/mL) y se expresa como´% m/V

Molaridad (M)
La molaridad (M), o concentración molar, es el número de moles de soluto por cada litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar). Para preparar una disolución de esta concentración habitualmente se disuelve primero el soluto en un volumen menor, por ejemplo 300 mL, y se traslada esa disolución a un matraz aforado, para después enrasarlo con más disolvente hasta los 1000 mL. la molaridad se expresa de la siguiente manera:
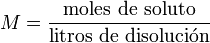
Es el método más común de expresar la concentración en química, sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, este proceso tiene el inconveniente de que el volumen cambia con la temperatura.
Se representa también como: M = n / V, en donde "n" son los moles de soluto (n=gr soluto/PM) y "V" es el volumen de la disolución expresado en litros.
Molalidad(m)
La molalidad (m) es el número de moles de soluto que contiene un kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
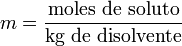
La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión. Es menos empleada que la molaridad pero igual de importante.
normalidad (N)
La normalidad (N) es el número de equivalentes (eq-g) de soluto (sto) por litro de disolución (Vsc).

El número de equivalentes se calcula dividiendo la masa total por la masa de un equivalente: n = m / meq, o bien como el producto de la masa total y la cantidad de equivalentes por mol, dividido por la masa molar: 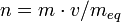 .
.
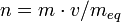 .
.Normalidad ácido-base
Es la normalidad de una disolución cuando se utiliza para una reacción como ácido o como base. Por esto suelen titularse utilizando indicadores de pH.
En este caso, los equivalentes pueden expresarse de la siguiente forma:
 para un ácido, o
para un ácido, o 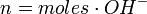 para una base.
para una base.
Donde:
- n es la cantidad de equivalentes.
- moles es la cantidad de moles.
- H+ es la cantidad de protones cedidos por una molécula del ácido.
- OH– es la cantidad de hidroxilos cedidos por una molécula de la base.
Por esto, podemos decir lo siguiente:
 para un ácido, o
para un ácido, o 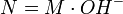 para una base.
para una base.
Donde:
- N es la normalidad de la disolución.
- M es la molaridad de la disolución.
- H+ es la cantidad de protones cedidos por una molécula del ácido.
- OH– es la cantidad de hidroxilos cedidos por una molécula de la base.
Ejemplos:
- Una disolución 1 M de HCl cede 1 H+, por lo tanto, es una disolución 1 N.
- Una disolución 1 M de Ca (OH)2 cede 2 OH–, por lo tanto, es una disolución 2 N.
Normalidad redox
Es la normalidad de una disolución cuando se la utiliza para una reacción como agente oxidante o como agente reductor. Como un mismo compuesto puede actuar como oxidante o como reductor, suele indicarse si se trata de la normalidad como oxidante (Nox) o como reductor (Nrd). Por esto suelen titularse utilizando indicadores redox.
En este caso, los equivalentes pueden expresarse de la siguiente forma:
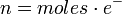 .
.
- n es la cantidad de equivalentes.
- moles es la cantidad de moles.
- e– es la cantidad de electrones intercambiados en la semirreacción de oxidación o reducción.
Por esto, podemos decir lo siguiente:
- .
Donde:
- N es la normalidad de la disolución.
- M es la molaridad de la disolución.
- e–: Es la cantidad de electrones intercambiados en la semirreacción de oxidación o reducción.
Ejemplos:
- En el siguiente caso vemos que el anión nitrato en medio ácido (por ejemplo el ácido nítrico) puede actuar como oxidante, y entonces una disolución 1 M es 3 Nox.

No hay comentarios:
Publicar un comentario